
Раковая мутация как главная надежда

Дорогие читатели, разрешите представить вам Ирину Якутенко, редактора отдела «Наука» портала lenta.ru. Ирина — молекулярный биолог и блестящий популяризатор науки, с ее статьями можно познакомиться тут. Сегодня она расскажет нам о громких сообщениях прошлой недели из области лечения рака.

На днях в газете The New York Times появилась статья о том, что группа американских докторов Онкологического центра Абрамсона при университете Пенсильвании — одном из ведущих клинических центров США, где занимаются исследованием и лечением рака — опробовала новый препарат для лечения меланомы, и результаты первых клинических испытаний оказались чрезвычайно успешными. Однако уже на следующий день в газете вышла новая статья про тот же препарат, и тон ее был отнюдь не таким радостным. Более того, сообщалось, что некоторые из больных, которым новое лекарство сначала помогло, умерли, причем умерли от меланомы. Думается, читатели этого уважаемого издания немало удивились такой неожиданной смене тона. Попробуем разобраться, что же это за препарат и произошла ли революция в методах лечения рака.
Сперва разочаруем читателей: революции не произошло. Новое лекарство, как выяснилось, способно убивать раковые клетки, но не способно полностью излечить больных от страшного недуга. Важность этого препарата в том, что он позволяет людям покупать время — время, когда они могут вести относительно комфортную жизнь и не испытывать боли. Но купить время смогут, увы, не все пациенты, а только те из них, чьи клетки несут некую конкретную мутацию. И это принципиальный момент, определяющий развитие современных методов лечения рака: исследуемое лекарство является одним из многочисленных на сегодняшний день соединений, которые лечат рак прицельно. То есть не просто убивают любые делящиеся клетки, а воздействуют на строго определенные процессы в клетках со строго определенными мутациями.
Вообще, в последние годы сам подход к восприятию и лечению онкологических заболеваний изменился самым кардинальным образом. Сейчас человек, узнав, что у него рак, в первую очередь задает вопрос: а что у меня за мутация? И вот это уже вполне можно назвать революцией.
Меланома — одна из самых распространенных на Земле разновидностей рака и одна из самых опасных. На меланому приходится около 3 процентов всех случаев рака кожи, но она ответственна за 75 процентов смертей от этого типа рака. И что самое неприятное, для многих больных меланомой стандартные методы терапии — лучевая и химиотерапия — не дают результатов. Именно поэтому врачи активно разрабатывают методы направленной терапии меланомы.
Препарат, который использовали герои публикации The New York Times, неудобоваримо называется PLX4032. Он работает только в раковых клетках, несущих мутацию V600E в гене BRAF. PLX4032 блокирует работу BRAF, что, в свою очередь, приводит к остановке сигнальной цепи RAF-MEK-ERK... Стоп-стоп-стоп. Все эти сокращения, кажется, совершенно не позволяют понять, как же действует новый препарат. Давайте зайдем с другой стороны.
Представьте, что у вас есть специальный микроскоп, при помощи которого вы можете видеть, что происходит внутри живых клеток. Причем вы наблюдаете не мешанину из движущихся структур, а видите только те реакции и процессы, которые являются критически важными для выживания клетки.
Ваши объекты наблюдения — две клетки меланомы, которые с виду практически не отличаются друг от друга. Единственная разница: в геноме первой клетки в одном из генов (BRAF) есть нарушение, мутация, которую ученые называют V600E. В геноме второй клетки такой мутации нет — в этом она похожа на все остальные клетки тела пациента. Увеличиваем резкость нашего микроскопа и видим, что в обеих клетках протекают реакции, в которых участвуют три белка — RAF, MEK и ERK. Как мы помним, наш микроскоп показывает только самые необходимые для жизни клеток процессы. Значит, если заблокировать цепь реакций RAF-MEK-ERK, обе раковые клетки умрут. Чтобы остановить реакции, можно «выключить» один или несколько из трех белков. Например, можно вывести из игры первый белок в цепочке — RAF.
Для этого нам пригодится новое лекарство — PLX4032. Оно как раз блокирует работу белка RAF. Добавляем препарат к нашим клеткам и смотрим на результат. Во второй клетке — у которой нет мутации V600E — мы по-прежнему видим все реакции. Дело в том, что нормальный, немутантный белок BRAF включает в клетках альтернативный механизм, который компенсирует «выключение» RAF. В первой клетке, у которой белок BRAF поврежден мутацией, альтернативный механизм включиться не может. Поэтому критически важная цепь реакций обрывается, и клетка умирает.
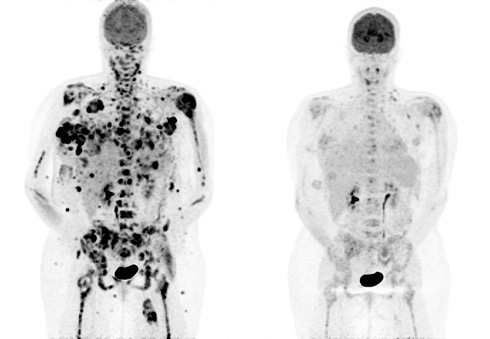
После множества подготовительных исследований врачи набрали группу больных меланомой добровольцев, чьи раковые клетки несли мутацию V600E, определили оптимальную дозу препарата (то есть такую дозу, когда лечебный эффект максимально выражен при минимальных побочных эффектах) и начали курс лечения.
За первые несколько месяцев практически у всех пациентов развитие меланомы замедлилось, опухоли стали уменьшаться в размерах и даже исчезать. Больше всего врачей поразило действие препарата на пациента, тело которого было буквально забито опухолями: уже через 15 дней большая часть новообразований исчезла. До начала испытаний врачи давали ему не больше месяца. Казалось, это был абсолютный триумф. Однако прошло еще несколько месяцев, и больным начало становиться хуже. Несмотря на постоянный прием PLX4032, по их телам вновь начали расползаться опухоли. В среднем, меланома брала верх над препаратом через девять месяцев после начала курса лечения. Двое больных уже умерли.
Врачи полагают, что болезнь возвращается по той причине, что раковые клетки находят обходный путь и умудряются запустить злосчастную цепь реакций RAF-MEK-ERK. Например, мутантный BRAF может активировать еще какой-то белок, который берет на себя обязанности «выключенного» RAF. Для того чтобы проверить эту гипотезу, необходимо выяснить, что это за белок, подобрать к нему ингибитор и провести клинические испытания, в которых пациенты будут принимать и этот ингибитор, и PLX4032. Подбор ингибитора и его испытания совместно с PLX4032 потребуют больших временных и финансовых затрат, поэтому фармацевтические компании не горят желанием немедленно начать все эти процедуры; надо сказать, там имеет место и еще одна бизнес-коллизия, о которой я могу рассказать подробнее в комментариях.
Если фармацевтические компании все-таки дадут добро, то принять участие в испытаниях сможет любой пациент с «нужной» мутацией. По статистике, мутацию V600E несут около 60 процентов пациентов с меланомой. Провериться на наличие мутации можно в любой больнице в США (и в некоторых медицинских учреждениях в России).
Итак, PLX4032 не смог окончательно избавить пациентов от меланомы. Однако благодаря ему больные как минимум на девять месяцев оказались избавлены от боли и лишние девять месяцев провели со своими близкими. Как сказала жена того самого пациента, который начал участие в испытаниях, имея в запасе в лучшем случае месяц (PLX4032 позволил ему продержаться еще год): «Это был год, который я ни на что не променяю». Думается, такой результат достоин исследований.
Препаратов, подобных PLX4032, которые лечат определенные виды рака, нацеливаясь на те или иные мутации, много, и число их постоянно растет. С их помощью врачи борются, например, с раком груди, немелкоклеточным раком легкого, различными видами лимфом и миелом. Не все они одинаково эффективны. Но чем больше врачи и ученые исследуют действие таких препаратов, тем яснее становится один момент: успех в применении того или иного препарата напрямую зависит от того, насколько он специфичен.
Для раковых пациентов результаты генетического анализа становятся едва ли не самыми важными результатами в их жизни. Есть мутация или нет? Если есть — сработает препарат или не сработает?
Да, раковые клетки научились обходить и эти специфичные препараты — они мутируют и начинают размножаться, несмотря на прием лекарства. Но, тем не менее, это уже контратаки, а не массированное наступление.