
Что защищает медведей от тромбоза вен и как это может помочь человеку
В России ежегодно фиксируется 80 тысяч случаев первичного тромбоза глубоких вен. Больше половины из них происходит во время и после госпитализации — это прямое следствие ограничения подвижности. В то же время наблюдения показывают, что у бурых медведей, которые проводят в спячке по полгода, таких проблем не возникает. О том, как медики планируют использовать эту способность, чтобы помочь людям, — в материале «Сноба»

Оркестр без первой скрипки и с сотней дирижеров
Без свертывания крови человек мог бы серьезно пострадать даже при небольшой царапине, что и происходит с больными гемофилией. Огромный оркестр белков со сложными механизмами обратной связи регулирует вязкость нашей крови и при необходимости подает сигнал тромбоцитам образовать сгусток и залатать рану. Но если хотя бы один инструмент в этом оркестре выходит из строя, вся мелодия нарушается: сгустки могут формироваться там, где они не нужны, затруднять ток крови и мешать питанию органов, что может привести к тяжелой болезни и даже смерти.
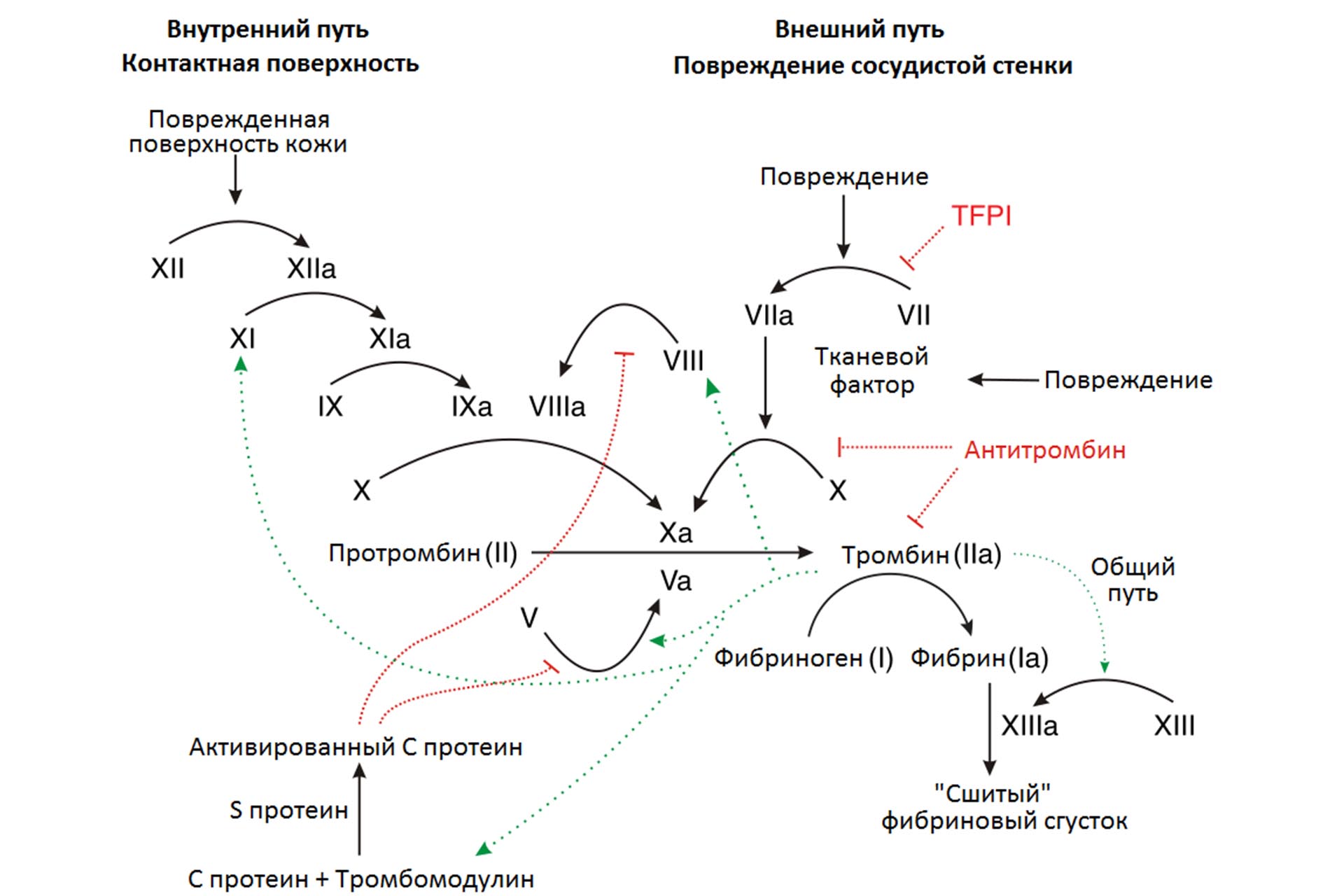
С венозным тромбозом борются с помощью антикоагулянтов. Эти препараты эффективны, но их дозировку сложно подобрать, а из-за нарушения режима приема и курса лечения проблема может вернуться или возникнут осложнения. В поисках новых способов лечения биологи обратили внимание на медведей, которые проводят в спячке пять-шесть месяцев в году и не страдают от венозного тромбоза. Выяснилось, что в тромбоцитах медведя в спячке понижены уровни индикаторов воспалительных процессов и белка теплового шока 47 (или HSP47), о функциях которого мы расскажем чуть ниже. Это не значит, что тромбов у медведей не бывает вообще, но долгие периоды без движения не представляют для них серьезной угрозы.
Почему медвежьи услуги оказались полезны для медицины
Это далеко не первая работа, посвященная тому, как организм медведей приспособился к спячке. По мнению ученых, бурые медведи могут стать «моделью болезней, связанных с сидячим образом жизни», ведь из-за долгой неподвижности они, кроме тромбоза, не страдают также от пролежней, атеросклероза, поражений костей, мышц, сердца и других органов, не теряют чувствительности к инсулину.
По физиологии медведи намного ближе к человеку, чем те же мыши, поэтому изучение их адаптации к спячке может нам помочь. Биологи берут анализ крови у медведей, живущих в дикой природе. Сравнивая образцы, взятые зимой и летом, ученые нашли и другие изменения, происходящие во время спячки. У медведей снижается уровень большинства белков в плазме крови, что позволяет не тратить много ресурсов на их синтез и экономить энергию. Но содержание нескольких белков сохраняется или растет: так, уровень глобулина, связывающего половые гормоны (ГСПГ), во время спячки повышен в 45 раз. Чем его больше, тем меньше стероидов будет в крови в свободном виде, чтобы участвовать в реакциях. У людей высокие уровни ГСПГ снижают риск диабета второго типа, ожирения, метаболического синдрома, повышенной чувствительности к инсулину и заболеваний сердца и сосудов. Правда, есть и минус — при высоком уровне ГСПГ может снижаться либидо, однако на фоне угрозы жизни это выглядит не самой чувствительной потерей.
Белок теплового шока и сети-ловушки
На тромбоз вен влияет и состояние слоя клеток, выстилающего сосуды изнутри, и множество белков, отвечающих за свертывание крови, и работа тромбоцитов, и иммунная система, и воспалительные процессы. Если пациент мало двигается, его венозный кровоток ограничен, страдают клетки внутренней выстилки сосудов. Кроме того, при долгой неподвижности активируются нейтрофилы (один из типов иммунных клеток крови) и тромбоциты. Вместе эти клетки крови создают специальные сети-«ловушки» (NETs) из нитей ДНК и белков-гистонов, чтобы противостоять повреждению клеток и поймать предполагаемого (с точки зрения иммунной системы) нарушителя –– патоген, вызывающий инфекцию. В сети попадают не только клетки бактерий, грибков и капсиды вирусов –– в них неизбежно застревают эритроциты и сами тромбоциты, а также молекулы, которые способствуют свертыванию крови. Во время заражения эта стратегия поможет побороть микроорганизмы в крови, однако порой иммунная система начинает работать чрезмерно сильно или включается по ошибке, из-за чего она поворачивается против своего хозяина. Когда патогена на самом деле нет или сетей появляется слишком много, внеклеточные ловушки нейтрофилов не помогают, а вредят организму: скопившиеся в них клетки и молекулы участвуют в формировании кровяного сгустка — тромба. Известно, что такие ловушки, построенные по ошибке иммунной системы, могут привести и к острому ишемическому инсульту.
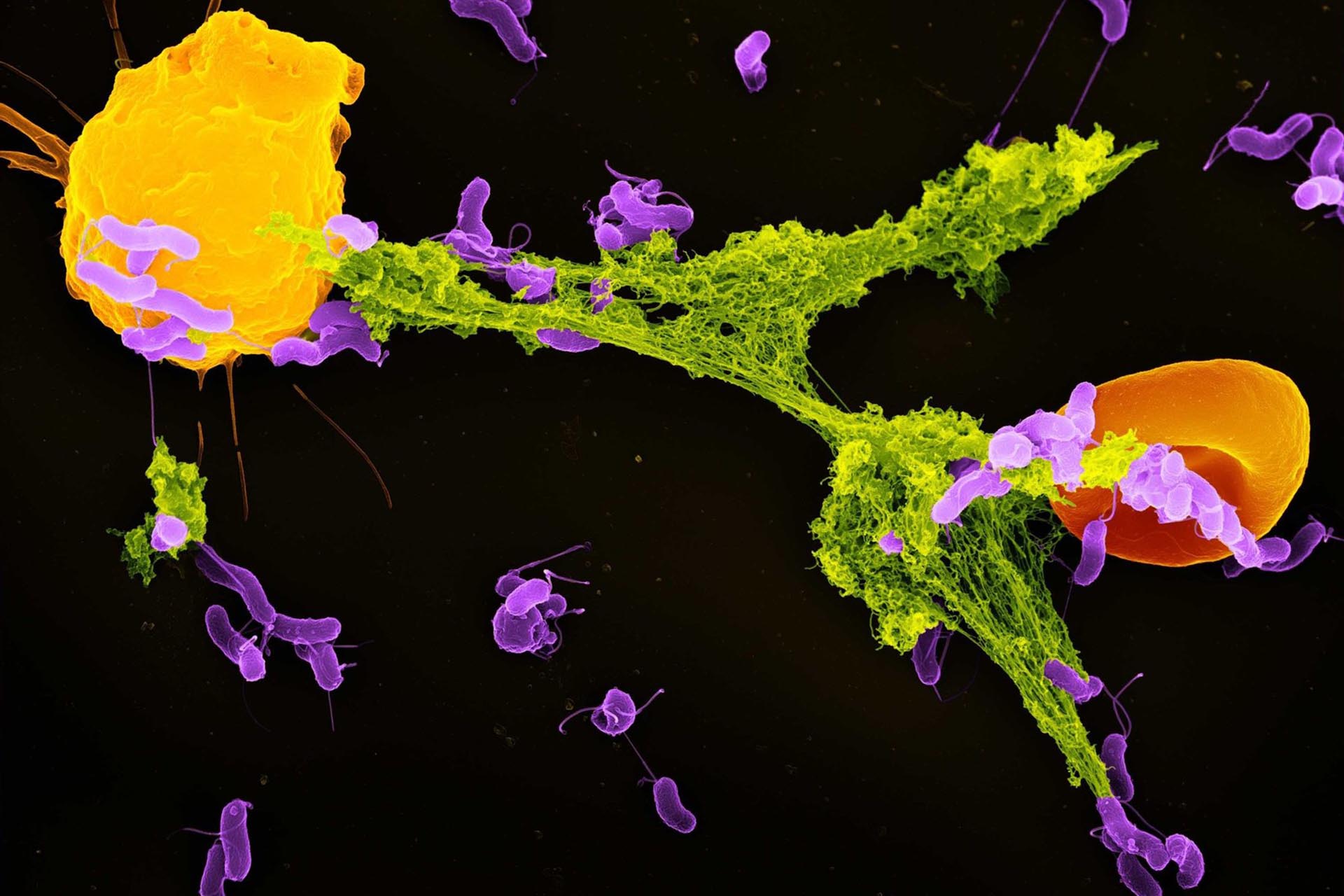
В создании NETs и тромбообразовании у млекопитающих задействован и белок HSP47 (белок теплового шока 47) — тот самый, которого у медведей в спячке становится меньше. Белки теплового шока в норме выполняют полезную роль: поддерживают работу клеток, попавших в стрессовые условия, регулируют воспалительный и иммунный ответ. HSP47 также помогает стабилизировать структуру белка-предшественника коллагена. Но в тромбоцитах, где вырабатывается HSP47, коллаген не производится. Зачем же им белок теплового шока с такой функцией? Дело в том, что коллаген –– основной белок соединительной ткани, который присутствует в стенке сосудов. Тромбоциты реагируют на коллаген как на сигнал о том, что сосуд поврежден и нужно скорее создавать кровяной сгусток. HSP47 также поощряет создание «ловушек», причем сразу двумя путями: через присоединение тромбоцитов и нейтрофилов друг к другу и через воздействие на толл-подобный рецептор II на поверхности нейтрофилов. Все эти механизмы приводят к росту риска венозного тромбоза у лежачих больных. Подсмотрев за медведями, организм которых ослабляет этот эффект во время спячки, можно найти способ профилактики тромбоза и у людей.
Исключение из правила и большие надежды
Авторы исследования не только изучали обездвиженных людей, но и в качестве контроля провели эксперимент со здоровыми добровольцами, которым прописали 27 дней постельного режима. У испытуемых содержание HSP47 в крови снизилось по сравнению с людьми, ведущими активную жизнь, а также с обездвиженными больными. Это значит, что в теории у больных людей уровень этого белка тоже можно уменьшить, как и у медведей в спячке. Более того, у здоровых людей без движения он снижается сам, хотя и не так сильно (вероятно, это и защищает здоровых волонтеров от повышенного риска тромбоза). Кроме того, наконец стало понятно, почему пациенты с повреждениями спинного мозга всегда были исключением из общего правила: медики давно заметили, что, несмотря на паралич, у этой группы больных нет повышенного риска венозного тромбоза. Ученые выяснили, что при параличе, возникшем из-за повреждения спинного мозга, уровень белка HSP47 тоже падает, что защищает эту группу больных от дополнительного риска. Правда, пока еще только предстоит разобраться, из-за чего снижается активность синтеза этого белка. Кроме того, авторы исследования подтвердили влияние HSP47 на тромбообразование в опытах на свиньях и на мышах.
Так что белок HSP47 и толл-подобный рецептор II выглядят как перспективные мишени, нежелательные взаимодействия которых можно было бы заблокировать лекарственной молекулой. Правда, пока неизвестно, как на механизм, по которому HSP47 стимулирует тромбоциты и нейтрофилы создавать «ловушки», влияют другие проблемы со здоровьем: нарушение работы факторов свертывания крови, диабет, рак, последствия долгого курения или ожирение. А ведь все эти заболевания и нарушения тоже повышают риск тромбоза. Несмотря на это и другие ограничения, это исследование важно для пациентов: до сих пор наука знала больше о том, что вызывает венозный тромбоз, чем о механизмах, которые позволяют его избежать. Эксперты считают, что благодаря новым знаниям о белке HSP47 можно разработать препарат, который защитит от тромбоза пациентов из группы высокого риска.